Zheng Yang1, Kin Y. Tam1
1 Fakultät für Gesundheitswissenschaften, Universität von Macau, Taipa, Macau, China.
Korrespondenz: Kin Y. TamFakultät für Gesundheitswissenschaften, Universität
vonMacau, Taipa, Macau
,
China
Tel.: +853-88224988
Fax: +853-88222314.
E-Mail: [email protected]
Received: 15. April 2016Überarbeitet
: 27. Juli 2016Akzeptiert
: 2. August 2016
Zusammenfassung
Die Glykolyse wurde bei den meisten Krebszellen als vorherrschender Prozess zur Verwertung von Glukose beobachtet, was als „Warburg-Effekt“ bezeichnet wurde. Die gezielte Beeinflussung kritischer Enzyme wie der Pyruvat-Dehydrogenase-Kinase (PDK), die den Prozess der Glykolyse umgekehrt regulieren, könnte ein vielversprechender Ansatz sein, der allein oder in Kombination mit anderen Behandlungen zur Krebstherapie eingesetzt werden kann. EGFR-Inhibitoren zur Behandlung von nicht-kleinzelligem Lungenkrebs (NSCLC) werden seit Jahrzehnten mit großem Erfolg in der klinischen Praxis eingesetzt, aber auch ihr klinischer Nutzen wurde durch die zunehmende erworbene Resistenz etwas beeinträchtigt. Die medikamentöse Kombinationstherapie ist eine wirksame Strategie zur Bewältigung dieser Herausforderung. In dieser Studie haben wir Dichloracetat (DCA), einen weithin anerkannten PDK-Inhibitor, zusammen mit Erlotinib und Gefitinib, zwei bekannten EGFR-Inhibitoren, eingesetzt und gezeigt, dass die Anwendung von DCA in Kombination mit Erlotinib oder Gefitinib die Lebensfähigkeit von EGFR-mutierten NSCLC-Zellen (NCI-H1975 und NCI-H1650) auf synergistische Weise deutlich abschwächt. Dieses synergistische Ergebnis scheint eher ein Kombinationseffekt zur Förderung der Apoptose zu sein als eine gleichzeitige Unterdrückung von EGFR- oder PDK-Signalwegen. Außerdem haben wir gezeigt, dass die Kombinationsbehandlung bei anderen NSCLC-Zelllinien ohne EGFR-Mutationen (A549 oder NCI-H460) keine synergistische Wirkung zeigte. Zusammengenommen deuten diese Beobachtungen darauf hin, dass die kombinierte Ausrichtung auf EGFR und PDK in NSCLC-Zellen synergistische Effekte in einer EGFR-Mutation-abhängigen Weise ausübte.
Schlüsselwörter: Pyruvat-Dehydrogenase-Kinase; Dichloracetat; Epidermaler Wachstumsfaktor-Rezeptor; Erlotinib; Gefitinib; Wirkstoffkombination
Copyright © 2016 Elsevier B.V. Alle Rechte vorbehalten.
EINLEITUNG
Nach den neuesten Statistiken (Jemal et al., 2011) steht Lungenkrebs bei Männern an erster und bei Frauen an fünfter Stelle der neu diagnostizierten Krebsfälle und der krebsbedingten Todesfälle weltweit, wobei mehr als 80 % der Patienten in die Kategorie nicht-kleinzelliger Lungenkrebs (NSCLC) fallen (Ke et al., 2015). Traditionelle Strategien zur Behandlung von NSCLC griffen häufig auf Chemotherapien zurück, bei denen Platin-basierte oder andere zytotoxische Chemikalien entweder als Mono- oder als Kombinationspräparate verabreicht wurden. Die objektiven Ansprechraten dieser Strategien waren jedoch in der Regel unbefriedigend, und die mediane Gesamtüberlebenszeit betrug in der Regel weniger als ein Jahr (Schiller et al., 2002, Pao und Chmielecki, 2010).
Eine EGFR-Mutation wurde bei etwa 30 % der NSCLC-Patienten gefunden, die oft gut auf die gezielte Therapie ansprachen (Pao und Chmielecki, 2010). Dies ermöglichte eine breite Anwendung von niedermolekularen EGFR-Tyrosinkinase-Inhibitoren (EGFR-TKis), die in den vergangenen Jahrzehnten enorme Erfolge erzielten (Hanahan und Weinberg, 2011), wie z. B. Erlotinib und Gefitinib (DuttaundMaity, 2007). Allerdings trat bei der Behandlung von Patienten mit EGFR-Inhibitoren in der Regel eine erworbene Resistenz auf, für die mehrere Mechanismen identifiziert wurden, wie z. B. eine ursprüngliche oder induzierte T790M-Hot-Spot-Mutation, eine aktivierte sekundäre Signalübertragung, wie z. B. eine MET-Amplifikation oder eine PI3K-Mutation, oder ein epithelialer bis mesenchymaler Übergang (EMT) (Maione et al., 2015). Enttäuschend ist, dass die kombinierte Anwendung von EGFR-Inhibitoren mit Chemotherapien mehr unerwünschte Wirkungen mit sich brachte als der erwartete Vorteil einer Verlängerung des Gesamtüberlebens der behandelten Objekte (Yan et al., 2015).
Der Stoffwechsel von Krebszellen ist ein aufstrebendes Gebiet, das auf der Entdeckung und der über ein halbes Jahrhundert andauernden Erforschung des „Warburg-Effekts“ beruht (Ngo et al., 2015), der besagt, dass Krebszellen dazu neigen, Glukose über Glykolyse statt über oxidative Phosphorylierung zu verstoffwechseln, um Energie zu erzeugen (Lu et al., 2015). Dieses Phänomen war der Auslöser für viele Studien, die sich auf Schlüsselenzyme des Glukosestoffwechsels konzentrierten, wie Glukosetransporter (GLUTs), Hexokinase2 (HK2), Pyruvatkinase M2 (PKM2), Pyruvatdehydrogenase-Kinase (PDK), Laktatdehydrogenase-A (LDHA) und Glutaminase, was zur Entwicklung mehrerer Inhibitoren führte, die auf spezifische Enzyme für die Krebstherapie abzielen (Butler et al., 2013). Als PDK-Inhibitor kann Dichloracetat (DCA) das Fortschreiten der Krebserkrankung bei vielen verschiedenen Krebsarten abschwächen, indem es die Pyruvatdehydrogenase-Phosphorylierung (p-PDH) herunterreguliert, die von der PDK gesteuert wird (Kankotia und Stacpoole, 2014). Obwohl mehrere Kombinationsstudien über die Anwendung von DCA zur Behandlung von NSCLC berichtet wurden, konzentrierten sich die meisten von ihnen auf die klassische zytotoxische Chemotherapie, d. h. den kombinierten Einsatz von DCA und platinbasierten Medikamenten (Garon et al., 2014, Olszewski et al., 2010). Ob die Kombination von DCA mit EGFR-TKi bei EGFR-mutiertem NSCLC einen synergetischen Effekt auf die Krebstherapie ausüben kann, ist noch unbekannt.
In dieser Studie konnten wir zeigen, dass die kombinierte Anwendung von EGFR-Inhibitoren (entweder Erlotinib oder Gefitinib) mit DCA das Zellwachstum von NCI-H1975 und NCI-H1650 synergistisch hemmt. Außerdem untersuchten wir die möglichen Mechanismen für die Kombinationswirkung von EGFR- und PDK-Inhibitoren. Wir fanden heraus, dass diese Kombinationen nur bei den EGFR-mutierten NSCLC-Zelllinien NCI-H1975 und NCI-H460, nicht aber bei den EGFR-Wildtyp-NSCLC-Zelllinien A549 und NCI-H460 Synergieeffekte erzielen können.
Materialien und Methoden
Zelllinien und Reagenzien
Die NSCLC-Zelllinien NCI-H1975, NCI-H1650 und A549 wurden von ATCC erworben, während NCI-H460 ein freundliches Geschenk von Prof. Thomas Y.C. Leung (Department of Applied Biology and Chemical Technology, Faculty of Applied Science and Textiles, The Hong Kong Polytechnic University) war. A549-Zellen wurden in F-12K/DMEM 1:1 (Gibco) kultiviert, während die anderen Zelllinien in RPMI 1640 (Gibco) mit einem Zusatz von 10 % fötalem Rinderserum (Gibco) in einer befeuchteten Atmosphäre mit 5%CO2 bei 37 °C gehalten wurden.
DCA wurde von Sigma gekauft und in 1% DMSO in PBS als Stammlösung (1,6 M) gelöst, die dann auf verschiedene Konzentrationen verdünnt wurde, um die endgültigen Arbeitslösungen zu bilden, die 0,1% DMSO im gesamten Medium für die Zellbehandlung enthielten. Erlotinib und Gefitinib, beide von SelleckChem, wurden zunächst in DMSO (Sigma) aufgelöst, um die Stammlösung mit einer Konzentration von 160 mM zu bilden, und dann auf die individuelle Konzentration der Arbeitsmedien wie die von DCA verdünnt. Primäre Antikörper, einschließlich p-PDH und PDH (Abcam), stammten von Cell Signaling Technology. α-Tubulin wurde von Invitrogen bezogen.
Zelllebensfähigkeitstest
Die Zelllebensfähigkeit jeder einzelnen behandelten oder unbehandelten Zelle wurde nach der angegebenen Behandlungszeit mit Hilfe des MTT-Tests bestimmt. Kurz gesagt, wurden einzelne Zellen für jede Zelllinie 24 Stunden vor dem Laden der Verbindungen in 96-Well-Platten ausgesät. Nach der angegebenen Zeitspanne (24 h, 48 h bzw. 72 h) wurden die Kulturmedien mit den Verbindungen verworfen und 100 μl frisches Vollmedium mit 0,5 mg/ml MTT (3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazoliumbromid, Sigma) hinzugefügt. Nach 4 Stunden Inkubation bei 37 °C wurde das Lösungsmittel entfernt und 100 μl DMSO in jede Vertiefung gegeben, wobei die Formazan-Kristalle durch leichtes Schütteln aufgelöst wurden. Der O.D.-Wert jeder Vertiefung wurde bei 570 nm mit dem SpectraMax M5 Microplate Reader (Molecular Devices) gemessen.
Berechnung des Kombinationsindex (CI)
Der CI-Wert wurde für die synergistische Bewertung der Zelllebensfähigkeit zwischen der Kombination und jeder der einzelnen Gruppen erfasst, die als Funktion des Anteils der betroffenen Krebszellen (Fa) auf der Grundlage der Chou-Talalay-Gleichung (Chou und Talalay, 1984) berechnet wurde: CI=(D)1/(Dx)1+(D)2/(Dx)2, wobei (D)1 und (D)2 die Dosen angeben, die zur Erzielung einer notwendigen Reaktion in der Kombination angewendet werden, und (Dx) sich auf die einzelnen Medikamentendosen bezieht, die zur Erzielung einer ähnlichen Reaktion erforderlich sind. Die Analysen der CI-Werte wurden mit der Software CalcuSyn (Biosoft) durchgeführt, wobei CI<1, CI=1 und CI>1 synergistische, additive bzw. antagonistische Wirkungen anzeigen.
Koloniebildungstest
Alle vier NSCLC-Zelllinien wurden in 6-Well-Platten ausgesät, wobei jede Vertiefung 200-800 Zellen in 2 ml Medium enthielt. Die Medien mit den einzelnen Wirkstoffen oder deren Kombination wurden 24 Stunden nach dem Animpfen der Zellen für eine kontinuierliche dreitägige Behandlung hinzugefügt und dann alle drei Tage durch wirkstofffreie Medien ersetzt. 15 Tage nach der Zellaussaat wurden die Zellkolonien 15 Minuten lang in 95%igem Ethanol fixiert, mit 0,1%igem Kristallviolett (Sigma) angefärbt und getrocknet. Kolonien mit mehr als 100 Zellen wurden als positiv gezählt.
Western-Blotting-Assay
Sowohl NCI-H1975- als auch A549-Zellen wurden in 6-Well-Platten ausgesät und für bestimmte Zeiträume mit Medien behandelt, die eine Mono-Verbindung oder eine Kombination enthielten. Die behandelten Zellen wurden 15 Minuten lang in Zelllysatpuffer (Cell Signaling Technology) unter leichtem Schütteln inkubiert und dann weitere 15 Minuten lang bei 12.000 U/min bei 4 °C zentrifugiert. Die Proteinkonzentration jeder Probe im Überstand wurde mit dem Pierce® BCA Protein Assay Kit (Thermo) bestimmt und auf das gleiche Niveau gebracht, gefolgt von einer 8-minütigen Proteindenaturierung mit SDS-Ladepuffer bei 100 °C. Die Proteine in der Probe wurden durch SDS-PAGE-Elektrophorese aufgetrennt, auf eine Nitrocellulose-Filtermembran (Whatman) übertragen, 2 Stunden lang in 5 % fettfreier Milch blockiert, über Nacht mit den gewünschten primären Antikörpern belüftet und anschließend 2 Stunden lang mit sekundärem HRP-gebundenem Anti-Kaninchen- oder Anti-Maus-IgG (Cell Signaling Technology) belüftet. Die Membranen wurden schließlich nach 2-minütiger Inkubation mit Clarity Western ECL-Substrat (Bio-Rad) in einem Chemidoc® MP Imaging System (Bio-Rad) gescannt.
Durchflusszytometrie-Assay
NCI-H1975-und
A549-Zellen wurden ausgesät und wie im vorherigen Abschnitt beschrieben behandelt. Die behandelten Zellen wurden mit Trypsin-EDTA (Gibco) vom Boden der Platten abgelöst und zweimal mit PBS gewaschen. Apoptotische Erkennungen wurden mit dem FITC Annexin-V Apoptotic Detection Kit (Biolegend) durchgeführt. Kurz gesagt wurden die geernteten Zellproben in 500 μl Bindungspuffer mit 5 μl Annexin V-FITC und 10 μl Propidiumiodid (PI) für 15 Minuten suspendiert, bevor die FACS-Analyse auf einem Accuri C6 Durchflusszytometer (BD) durchgeführt wurde. Zellproben für die Messung des mitochondrialen Membranpotenzials (MMP) wurden 15 Minuten lang in 1 ml Vollmedium mit 2 μM JC-1 (5,5,6,6-Tetrachlor-1,1,3,3-tetraethylbenzimidazolycarcocyaninjodid, Sigma) inkubiert, anschließend einmal gewaschen und für die FACS-Analyse in PBS resuspendiert.
Statistische Analyse
Alle Daten wurden als Mittelwert±S.D. dargestellt. Die IC50 der einzelnen Verbindungen zu den angegebenen Zeitpunkten wurden mit GraphPad 5.1 (Prism) ermittelt. Statistische Vergleiche zwischen verschiedenen Probengruppen wurden mit Excel 2010 unter Verwendung des Student’s t-Tests durchgeführt. Ein P-Wert von weniger als 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Erlotinib, Gefitinib und DCA verringerten die Zellproliferation in den NSCLC-Zelllinien NCI-H1975 und A549
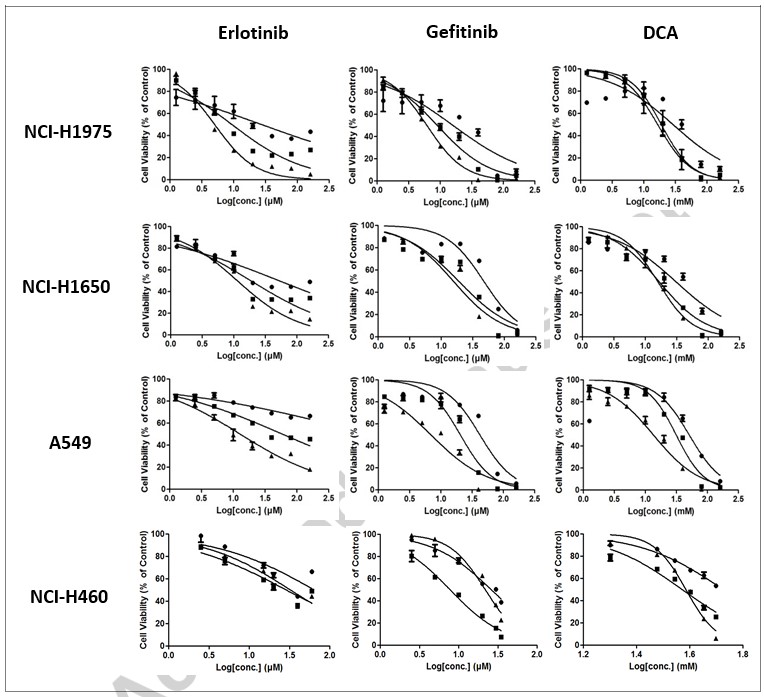
Wir untersuchten in vitro die zellproliferationshemmende Wirkung der drei ausgewählten Verbindungen in den NSCLC-Zelllinien NCI-H1975, NCI-H1650, A549 und NCI-H460. Die Zellen wurden 24 Stunden, 48 Stunden bzw. 72 Stunden lang mit einer abnehmenden 2-fachen Verdünnungsreihe der einzelnen Verbindungen behandelt. Die Lebensfähigkeit der Zellen wurde mit dem MTT-Assay bestimmt. Wie aus Abb. 1 hervorgeht, führten Erlotinib, Gefitinib oder DCA bei allen vier Zelllinien dosis- und zeitabhängig zu einer signifikanten Abnahme der Zelllebensfähigkeit. Es ist zu erkennen, dass die Variabilität der IC50-Daten bei den meisten Zelllinien nach 72 Stunden geringer zu sein scheint (siehe Tabelle 1). Daher wählten wir 72 Stunden als Endpunkt für die Kombinationsbehandlung.
| NCI-H1975 | NCI-H1650 | A549 | NCI-H460 | ||
| Erlotinib (μM) | 24 h | 27.33±15.06 | 52.69±0.80 | N/A | K.A |
| 48 h | 9.45±1.48 | 18.67±0.66 | 59.66±3.06 | 28.72±3.29 | |
| 72 h | 5.04±0.01 | 11.42±0.10 | 13.14±3.70 | 32.66±3.32 | |
| Gefitinib (μM) | 24 h | 16.22±8.37 | 47.30±3.98 | 41.96±3.38 | 26.19±1.98 |
| 48 h | 9.09±1.91 | 18.97±0.62 | 20.66±2.95 | 7.74±0.37 | |
| 72 h | 6.15±0.18 | 15.61±1.15 | 6.97±0.22 | 21.86±0.09 | |
| DCA (mM) | 24 h | 29.51±3.25 | 31.09±4.10 | 50.25±6.89 | K.A |
| 48 h | 19.56±6.31 | 16.84±4.53 | 31.35±1.00 | 37.26±0.47 | |
| 72 h | 16.60±4.46 | 15.81±0.26 | 13.55±2.32 | 38.47±0.35 |
Kombinierte Strategien unterdrückten die Zelllebensfähigkeit synergistisch und hemmten die Koloniebildung signifikant bei NCI-H1975 und NCI-H1650, funktionierten aber nicht so gut bei A549 und NCI-H460
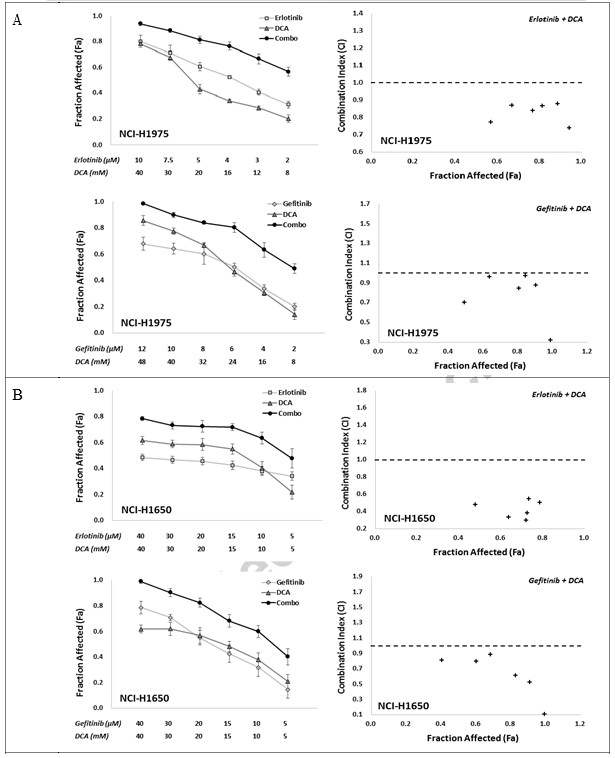
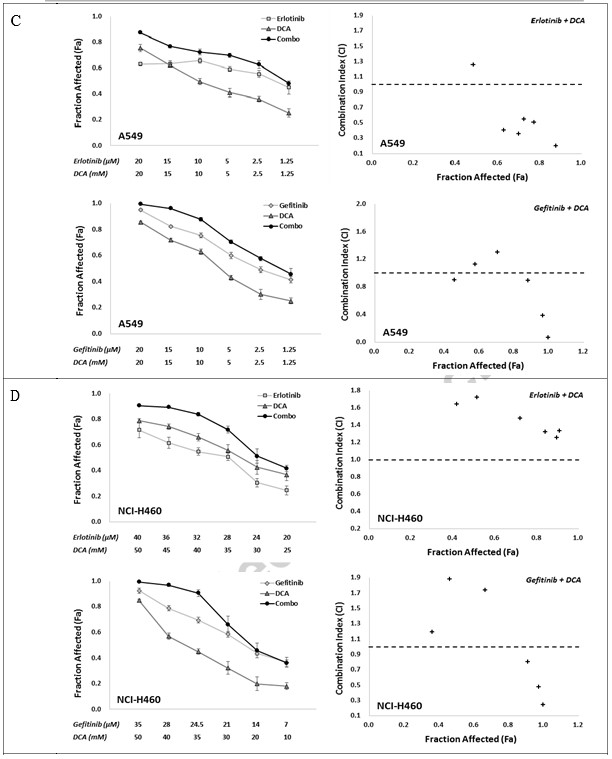
Um die synergistische Reaktion auf die Kombination von EGFR-Inhibitoren mit DCA in vitro zu bestimmen, verwendeten wir zwei Kombinationsstrategien, nämlich Erlotinib mit DCA und Gefitinib mit DCA, mit sechs individuellen Behandlungskonzentrationen für jede Verbindung, die die Zelllebensfähigkeit in einem festen Verhältnis zwischen etwa IC80 und IC20 beeinflussten. Die Kombinationswirkungen wurden mit dem MTT-Assay bewertet. Wie in Abb. 2 gezeigt, zeigten beide Kombinationen, Erlotinib mit DCA und Gefitinib mit DCA, eindeutig Synergieeffekte bei den Zelllinien NCI-H1975 und NCI-H1650, wobei die CI-Werte in allen kombinierten Gruppen niedriger als 1 waren (Abb. 2A und B). Bei den Zelllinien A549 und NCI-H460 zeigten zwar alle Kombinationsgruppen in zwei Strategien einen erhöhten Fa-Wert im Vergleich zu ihren Mono-Anwendungen, aber die CI-Werte einiger Kombinationsgruppen lagen über 1 (Abb. 2C und D), was darauf hindeutet, dass die Kombinationsstrategien bei A549 und NCI-H460 nicht so gut funktionierten wie bei NCI-H1975 und NCI-H1650.
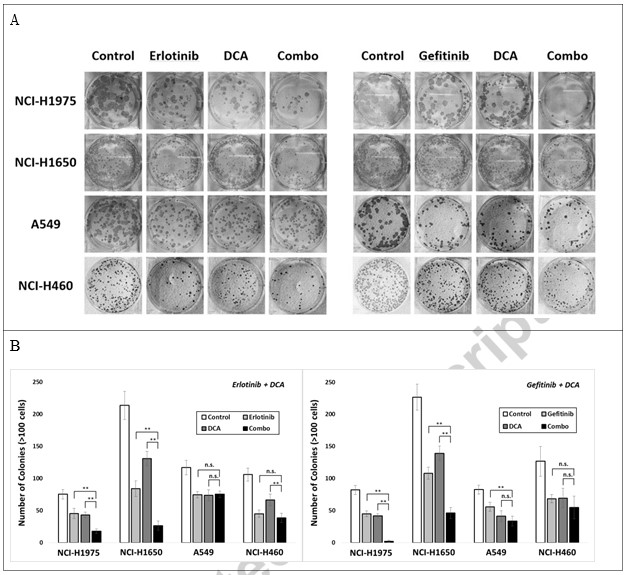
Um weiter zu untersuchen, ob die Kombination die Koloniebildung von Krebszellen abschwächen kann, setzten wir diese vier Zelllinien in 6-Well-Platten aus und behandelten sie entweder mit Erlotinib, Gefitinib oder DCA in Konzentrationen, die eine Koloniehemmung von etwa 40 % erreichen, oder mit deren Kombinationen für drei Tage. 15 Tage nach dem Ausplattieren der Zellen wurden Kolonien mit mehr als 100 Zellen gezählt; die Daten sind in Abb. 3 dargestellt. Die Kombinationsbehandlung von Erlotinib mit DCA führte zu einer signifikanten Unterdrückung der Koloniebildung bei NCI-H1975 und NCI-H1650, nicht aber bei A549 und NCI-H460, was darauf hindeutet, dass die Kombinationsstrategie möglicherweise nur bei NCI-H1975 und NCI-H1650, den EGFR-mutierten NSCLC-Zellen, funktioniert.
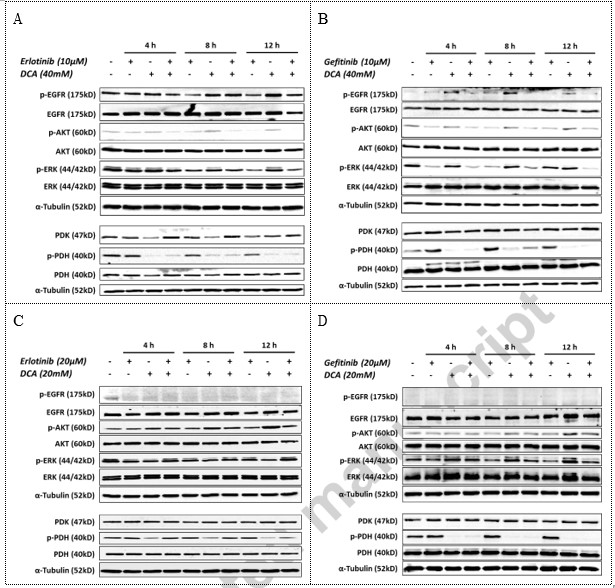
Erlotinib/Gefitinib und DCA wirkten unabhängig voneinander in ihren gezielten Signalwegen in der Zelllinie NCI-H1975
Um die möglichen Auswirkungen der Kombination auf die Signalwege zu untersuchen, führten wir Western-Blotting-Analysen durch, um die relevanten Phosphorylierungsereignisse in den NSCLC-Zellen NCI-H1975 und A549 zu bestimmten Zeitpunkten während der Behandlung mit dem Kombinationspräparat zu untersuchen. Wie in Abb. 4 gezeigt, unterdrückten Erlotinib oder Gefitinib in der EGFR-mutierten Zelllinie NCI-H1975 den Gehalt an phosphoryliertem EGFR sowie an phosphoryliertem AKT und phosphoryliertem ERK1/2, zwei Schlüsselproteinen, die im Downstream des EGFR-Signalwegs liegen, verringerten aber nicht den Gehalt an phosphoryliertem PDH. DCA hingegen hemmte die PDH-Phosphorylierung signifikant, verringerte aber nicht den Gehalt an phosphorylierten Schlüsselproteinen der EGFR-Signalübertragung in NCI-H1975 (Abb. 4A und B). In A549 EGFR-Wildtyp-NSCLC-Zellen hatten Erlotinib und Gefitinib jedoch keinen Einfluss auf die nachgeschaltete EGFR-Signalübertragung, z. B. auf die phosphorylierte AKT und phosphorylierte ERK, während DCA die phosphorylierte PDH signifikant verringerte (Abb. 4C und D). Interessanterweise schien DCA in beiden unabhängigen Studien AKT zu aktivieren, indem es dessen Phosphorylierungsgrad im Laufe der Zeit anhob (Abb. 4C und D). Diese Daten deuten darauf hin, dass Erlotinib und DCA unabhängig voneinander auf ihren jeweiligen Signalweg wirken.
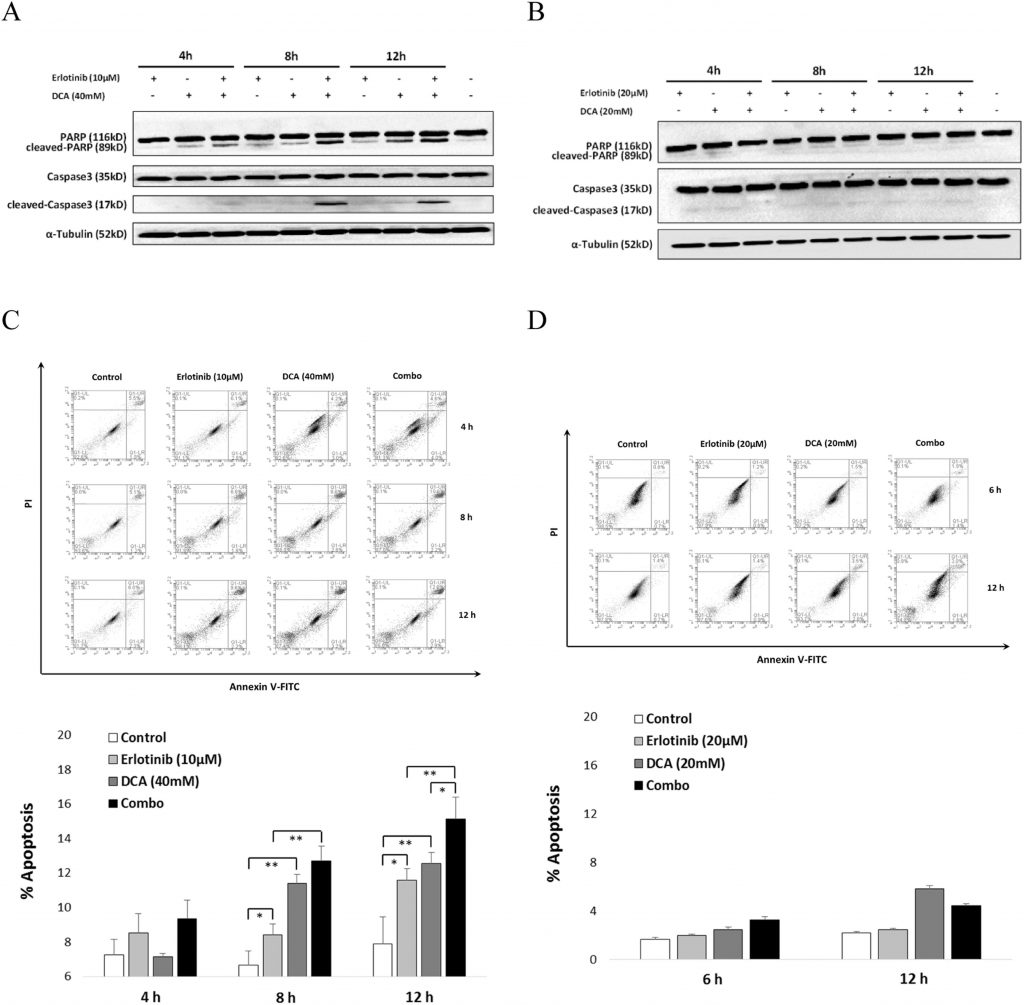
DieKombination von Erlotinib und DCA steigerte die Zellapoptose in NCI-H1975 signifikant, nicht aber in A549
Um die synergistische Wirkung von Erlotinib und DCA auf die Zelllebensfähigkeit zu erklären, untersuchten wir, ob sie gemeinsam die Zellapoptose förderten. Wie in Abb. 5 dargestellt, zeigten die Ergebnisse des Western Blotting, dass die Kombination zu einer signifikanten Aktivierung von Caspase3 und seinem Substrat, gespaltenem PARP, nach 8-stündiger Behandlung in NCI-H1975 führte (Abb. 5A), während in A549 keine offensichtliche Aktivierung von Caspase3 oder PARP beobachtet wurde (Abb. 5B). Weitere FACS-Analysen zeigten, dass Erlotinib in Kombination mit DCA einen signifikant größeren Anteil der Apoptose von NCI-H1975-Zellen förderte als jeder Wirkstoff allein, nachdem die Zellen 12 Stunden lang behandelt worden waren (Abb. 5C), während die Kombination keine Zellapoptose in A549-Zellen induzieren konnte, weder in der Mono-Anwendung noch in der kombinierten Form (Abb. 5D). Diese Ergebnisse deuten darauf hin, dass die kombinierte Verstärkung der Apoptoseinduktion durch Erotinib und DCA nur bei NCI-H1975, den EGFR-Mutantenzellen, aber nicht bei A549, den EGFR-Wildtyp-NSCLC-Zellen, wirksam ist.
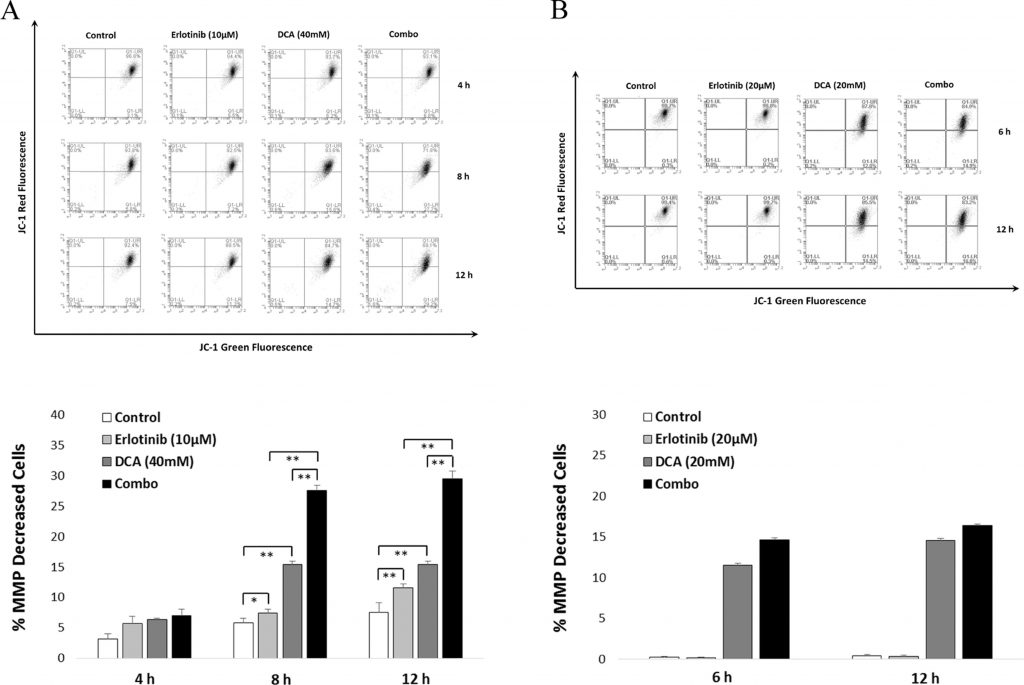
DieMMP sank bei der Kombinationsstrategie signifikant gegenüber der Monotherapie bei NCI-H1975
Um die signifikante Wirkung der Kombinationsbehandlung auf die Zellapoptose weiter zu bestätigen, verwendeten wir den JC-1-Test, um festzustellen, ob die Behandlung zu einem Rückgang der MMP, einem der Kennzeichen der Zellapoptose, führen kann. Wie in Abb. 6 gezeigt, stimmten die FACS-Daten mit den in Abschnitt 3.4 dargestellten Ergebnissen zur Zellapoptose überein. Es ist zu erkennen, dass die Kombination sowohl nach 8- als auch nach 12-stündiger Behandlung einen signifikanten MMP-Rückgang im Vergleich zu einer Mono-Anwendung von Erlotinib oder DCA in NCI-H1975-Zellen zeigte (siehe Abb. 6A). Bei A549-Zellen konnte ein MMP-Rückgang nur bei Anwendung von DCA festgestellt werden (siehe Abb. 6B).
Diskussion
Um unsere Hypothese zu testen, dass die Kombination von EGFR-Inhibitoren mit dem PDK-Inhibitor DCA bei NSCLC-Zellen synergistisch eine krebshemmende Wirkung entfalten könnte, haben wir einen MTT-Test zur Bewertung der Zellviabilität durchgeführt. Die Ergebnisse dieser Studie standen in guter Übereinstimmung mit der Hypothese. Insbesondere konnten wir zeigen, dass EGFR-Inhibitoren (Erlotinib oder Gefitinib) zusammen mit DCA die Lebensfähigkeit von NCI-H1975- und NCI-H1650-Zellen synergistisch abschwächten, wobei alle CI-Werte <1 bei verschiedenen Dosisstufen der Wirkstoffkombinationen lagen und die Koloniebildung von Krebszellen signifikant verringert wurde (Abb. 2, Abb. 3). Diese synergistischen Effekte zeigten sich jedoch nicht in den A549- oder NCI-H460-Zelllinien (EGFR-Wildtyp-NSCLC-Zelllinien), was darauf hindeutet, dass die Kombinationsstrategie die Zellprogression wahrscheinlich nur bei NSCLCs mit EGFR-Mutation auf synergistische Weise unterdrückt.
Velpula et al. (2013) berichteten, dass die Verabreichung von Erlotinib oder Gefitinib die Expression von p-EGFR und PDK1 in U251 und 5310 verringerte, während die Anwendung von DCA in diesen beiden Zellen die Expression von p-EGFR und PDK1 ebenfalls verringerte. Es ist plausibel, dass die Kombinationswirkung von EGFR- und PDK-Inhibitoren auf die gleichzeitige Unterdrückung entweder des EGFR- oder des PDK-Signalwegs zurückzuführen sein könnte. Vor diesem Hintergrund führten wir eine Western-Blotting-Analyse durch, um die Proteinveränderungen in diesen beiden Signalwegen zu untersuchen. Es hat sich gezeigt, dass sowohl Erlotinib als auch Gefitinib die Phosphorylierung des EGFR sowie die Phosphorylierung von zwei seiner klassischen nachgeschalteten Signalproteine, nämlich AKT und ERK, hemmten. Obwohl der PDK-Inhibitor DCA die PDK1-Expression leicht abschwächte, wurde die Phosphorylierung von PDH, einem Schlüsselenzym, das für die Umwandlung von Pyruvat in Acetyl-CoA für den Zitronensäurezyklus verantwortlich ist, anstatt die Glykolyse in Gang zu setzen (Kankotia und Stacpoole, 2014), bei der Anwendung von DCA deutlich unterdrückt (Abb. 4). Offensichtlich wirkten Erlotinib/Gefitinib und DCA in NCI-H1975-Zellen weder als Crosstalk noch als additive Hemmwirkung auf die gegenseitige Signalübertragung. Unsere Daten deuten darauf hin, dass der synergistische Anti-Krebs-Effekt der Medikamentenkombination bei NCI-H1975 nicht allein von EGFR- oder PDK-Signalwegen abhängt.
Um andere mögliche Mechanismen der Kombinationswirkung zu finden, richteten wir unsere Aufmerksamkeit auf die Induktion der Apoptose. Es wurde berichtet, dass Erlotinib in der Lage ist, die Apoptose von NCI-H1975-Zellen zu induzieren (Nie et al., 2015), und auch DCA führte in verschiedenen Krebszellen zur Apoptose (Madhok et al., 2010, Wong et al., 2008). Da die Spaltung von Caspase3 und ihr Zielspaltsubstrat PARP zwei Elemente sind, die an der Zellapoptose beteiligt sind (Zhang et al., 2015), untersuchten wir zunächst das Aktivierungsniveau von Caspase3 und PARP in NCI-H1975, wenn es entweder mit Erlotinib oder DCA allein oder in Kombination behandelt wurde. Unsere Ergebnisse deuten darauf hin, dass gespaltenes PARP mit einer Größe von 89 kDa zeitabhängig anstieg, wenn entweder Erlotinib oder DCA allein behandelt wurden. Wichtig ist, dass die Kombinationsbehandlung eine signifikant höhere PARP-Aktivität aufwies als die alleinige Anwendung der Substanzen. Die Expression der gespaltenen Caspase3 bei 17 kDa, die nach 8 Stunden ihren Höhepunkt erreichte, stieg stark an, wenn die NCI-H1975-Zelle mit der Kombination von Erlotinib und DCA behandelt wurde (Abb. 5A). Diese Ergebnisse deuten darauf hin, dass die Kombinationswirkung wahrscheinlich auf den additiven Effekt bei der Förderung der Zellapoptose zurückzuführen ist. Dies wurde auch durch die durchflusszytometrische Analyse der mit Annexin-V und PI doppelt gefärbten Zellen bestätigt. Diese Beobachtungen stimmten mit der Analyse der Caspase3- und PARP-Aktivierung überein, bei der die Kombinationsbehandlung zu einer mäßigen, aber erkennbaren Induktion der Zellapoptose führte, wenn die NCI-H1975-Zellen 12 Stunden lang behandelt wurden, verglichen mit der alleinigen Anwendung von Erlotinib oder DCA (Abb. 5B). In der A549-Zelllinie wurden jedoch weder aktivierte Caspase3/PARP noch eine synergistische Induktion der Zellapoptose beobachtet (Abb. 5A und B), was darauf hindeutet, dass die Förderung der Apoptose der mögliche Mechanismus für die Kombinationswirkung von Erlotinib und DCA auf EGFR-mutierte NSCLC-Zellen sein könnte.
Der Prozess der Zellapoptose kann in eine Reihe von Phasen unterteilt werden, wie z. B. die Veränderung der Zellmorphologie, der Verlust des mitochondrialen Membranpotenzials, die Veränderung der Permeabilität, die Fragmentierung der DNA usw. (Fiandalo und Kyprianou, 2012). Die Verringerung der MMP wurde in mehreren Studien als Folge der DCA-Behandlung in Krebszellen berichtet (Emadi et al., 2015). Frühere Studien haben gezeigt, dass Erlotinib zum Verlust von MMP in NSCLCs führt (Qian et al., 2009). Um zu untersuchen, ob die Kombination die MMP in NCI-H1975 signifikant beeinflussen kann, nutzten wir den Mitoprobe-JC-1-Assay, um das MMP-Niveau nach der Behandlung mit Erlotinib, DCA oder der Kombination zu bewerten. Wie in Abb. 6 gezeigt, führte die Kombination zu einem signifikanten Rückgang der MMP nach 8 und 12 Stunden Behandlung in NCI-H1975-Zellen (aber nicht in A549-Zellen), was darauf hindeutet, dass der Kombinationseffekt der induzierten Zellapoptose mit der Depolarisierung des mitochondrialen Membranpotenzials verbunden ist.
Zusammenfassend haben wir gezeigt, dass der kombinierte Einsatz von EGFR-Inhibitor, nämlich Erlotinib oder Gefitinib, und PDK-Inhibitor, DCA, einen synergistischen Anti-Krebs-Effekt in NCI-H1975- und NCI-H1650-Zellen zeigte. Die gemeinsame Förderung der Zellapoptose wurde als einer der wahrscheinlichen Mechanismen der Kombinationswirkung identifiziert. Insbesondere aktivierte die kombinierte Anwendung von Erlotinib und DCA nicht nur Caspase3 und PARP, sondern verringerte auch die MMP signifikant. Darüber hinaus deuteten unsere Ergebnisse darauf hin, dass die Kombinationswirkung nur bei NSCLC-Zellen mit EGFR-Mutationen auf der Grundlage unserer vorliegenden Ergebnisse sichtbar sein könnte. In unserem Labor werden derzeit weitere Untersuchungen durchgeführt, um diese Beobachtung bei weiteren NSCLC-Zelllinien zu bestätigen.
Interessenkonflikt
Die Autoren erklären, dass für diesen Artikel kein Interessenkonflikt besteht.
Rolle der Finanzierungsquelle
Diese Arbeit wurde vom Science and Technology Development Fund, Macao S.A.R (FDCT) (Projektreferenz Nr. 086/2014/A2) und der Universität von Macau (Zuschuss Nr. MRG021-TKY-2015-FHS) unterstützt.
Danksagungen
Wir bedanken uns für die finanzielle Unterstützung durch den Science and Technology Development Fund, Macao S.A.R (FDCT) (Projektreferenz Nr. 086/2014/A2) und die Universität von Macau (Grant Nr. MRG021-TKY-2015-FHS). Wir danken Prof. Thomas Y.C. Leung (PolyU, HK) für Proben von NCI-H460-Zellen. Unser Dank gilt Dr. Xiaohui Hu für hilfreiche Diskussionen und das Korrekturlesen des Manuskripts.
REFERENZEN
1 Butler et al., 2013 E.B. Butler, Y. Zhao, C. Muñoz-Pinedo, J. Lu, M. Tan Den Motor der Resistenz abwürgen: Angriff auf den Krebsstoffwechsel zur Überwindung der Therapieresistenz Cancer Res. 73 (2013), S. 2709-27172 Chou und Talalay, 1984 T.C. Chou, P. Talalay Quantitative Analyse von Dosis-Wirkungs-Beziehungen: die kombinierte Wirkung mehrerer Medikamente oder Enzyminhibitoren Adv. Enzym. Regul., 22 (1984), S. 27-55
3 Dutta und Maity, 2007 P.R. Dutta, A. Maity Zelluläre Reaktionen auf EGFR-Inhibitoren und ihre Bedeutung für die Krebstherapie Cancer Lett. 254 (2007), S. 165-177
4 Emadi et al. (2015) A. Emadi, M. Sadowska, B. Carter-Cooper, V. Bhatnagar, I. van der Merwe, M.J. Levis, E.A. Sausville, R.G. Lapidus Störung des zellulären oxidativen Zustands durch Dichloracetat und Arsentrioxid zur Behandlung der akuten myeloischen Leukämie Leuk. Res., 39 (2015), S. 719-729
5 Fiandalo und Kyprianou, 2012 M.V. Fiandalo, N. Kyprianou Caspase-Kontrolle: Protagonisten der Apoptose von Krebszellen Exp. Oncol., 34 (2012), S. 165-175
6 Garon et al., 2014 E.B. Garon, H.R. Christofk, W. Hosmer, C.D. Britten, A. Bahng, M.J. Crabtree, C.S. Hong, N. Kamranpour, S. Pitts, F. Kabbinavar, C. Patel, E. von Euw, A. Black, E.D. Michelakis, S.M. Dubinett, D.J. Slamon Dichloracetat sollte bei fortgeschrittenem nicht-kleinzelligem Bronchialkarzinom in Verbindung mit einer platinbasierten Chemotherapie bei hypoxischen Tumoren und nicht als Einzelwirkstoff in Betracht gezogen werden J. Cancer Res. Clin. Oncol., 140 (2014), S. 443-452
7 Hanahan und Weinberg, 2011 D. Hanahan, R.A. Weinberg Kennzeichen von Krebs: die nächste Generation Cell, 144 (2011), S. 646-674
8 Jemal et al. (2011) A. Jemal, F. Bray, M.M. Center, J. Ferlay, E. Ward, D. Forman Globale Krebsstatistiken CA: Cancer J. Clin., 61 (2011), S. 69-90
9 Kankotia und Stacpoole, 2014 S. Kankotia, P.W. Stacpoole Dichloracetat und Krebs: neue Heimat für ein Orphan Drug? Biochim. Biophys. Acta, 1846 (2014), S. 617-629
10 Ke et al. (2015) E.E. Ke, Q. Zhou, Y.L. Wu Neue Paradigmen bei zielgerichteten Behandlungen für asiatische Patienten mit NSCLC Expert Opin. Pharmacother., 16 (2015), S. 1167-1176
11 Lu et al. (2015) J. Lu, M. Tan, Q. Cai Der Warburg-Effekt bei der Tumorprogression: Mitochondrialer oxidativer Stoffwechsel als Anti-Metastasen-Mechanismus Cancer Lett. 356 (2015), S. 156-164
12 Madhok et al. (2010) B.M. Madhok, S. Yeluri, S.L. Perry, T.A. Hughes, D.G. Jayne Dichloracetat induziert Apoptose und Zellzyklus-Stillstand in Darmkrebszellen Br. J. Cancer, 102 (2010), S. 1746-1752
13 Maione et al. (2015) P. Maione, P.C. Sacco, A. Sgambato, F. Casaluce, A. Rossi, C. Gridelli Überwindung der Resistenz gegen zielgerichtete Therapien bei NSCLC: aktuelle Ansätze und klinische Anwendung Ther. Adv. Med. Oncol., 7 (2015), S. 263-273
14 Ngo et al. (2015) H. Ngo, S.M. Tortorella, K. Ververis, T.C. Karagiannis Der Warburg-Effekt: molekulare Aspekte und therapeutische Möglichkeiten Mol. Biol. Rep., 42 (2015), S. 825-834
15 Nie et al. (2015) P. Nie, W. Hu, T. Zhang, Y. Yang, B. Hou, Z. Zou Synergistische Induktion der Erlotinib-vermittelten Apoptose durch Resveratrol in menschlichen nicht-kleinzelligen Lungenkrebszellen durch Herunterregulieren von Survivin und Hochregulieren von PUMA Zellphysiol. Biochem. 35 (2015), S. 2255-2271
16 Olszewski et al. (2010) U. Olszewski, T.T. Poulsen, E. Ulsperger, H.S. Poulsen, K. Geissler, G. Hamilton In-vitro-Zytotoxizität von Kombinationen von Dichloracetat mit krebsbekämpfenden Platinverbindungen Clin. Pharmacol, 2 (2010), S. 177-183
17 Pao und Chmielecki, 2010 W. Pao, J. Chmielecki Rationale, biologisch basierte Behandlung von nicht-kleinzelligem Lungenkrebs mit EGFR-Mutation Nat. Rev. Cancer, 10 (2010), S. 760-774
18 Qian et al., 2009 X. Qian, J. Li, J. Ding, Z. Wang, W. Zhang, G. Hu Erlotinib aktiviert mitochondriale Todeswege in Verbindung mit der Produktion reaktiver Sauerstoffspezies in der menschlichen nicht-kleinzelligen Lungenkrebs-Zelllinie A549 Clin. Exp. Pharmacol. Physiol. 36 (2009), S. 487-494
19 Schiller et al., 2002 J.H. Schiller, D. Harrington, C.P. Belani, C. Langer, A. Sandler, J. Krook, J. Zhu, D.H. Johnson Vergleich von vier Chemotherapieschemata bei fortgeschrittenem nicht-kleinzelligem Lungenkrebs N. Engl. J. Med., 346 (2002), S. 92-98
20 Velpula et al. (2013) K.K. Velpula, A. Bhasin, S. Asuthkar, A.J. Tsung Kombiniertes Targeting von PDK1 und EGFR löst Rückbildung des Glioblastoms durch Umkehrung des Warburg-Effekts aus Cancer Res. 73 (2013), S. 7277-7289
21 Wong et al., 2008 J.Y. Wong, G.S. Huggins, M. Debidda, N.C. Munshi, I. De Vivo Dichloracetat induziert Apoptose in Endometriumkrebszellen Gynecol. Oncol., 109 (2008), S. 394-402
22 Yan et al. (2015) H. Yan, H. Li, Q. Li, P. Zhao, W. Wang, B. Cao Die Wirksamkeit der synchronen Kombination von Chemotherapie und EGFR-TKI bei der Erstlinienbehandlung von NSCLC: eine systematische Analyse PLoS One, 10 (2015), S. e0135829
23 Zhang et al. (2015) L. Zhang, F. Dai, P.L. Sheng, Z.Q. Chen, Q.P. Xu, Y.Q. Guo Das Resveratrol-Analogon 3,4,4′-Trihydroxy-trans-Stilben induziert Apoptose und Autophagie in menschlichen nicht-kleinzelligen Lungenkrebszellen in vitro Acta Pharmacol. Sin., 36 (2015), S. 1256-1265
Verwandte Inhalte: